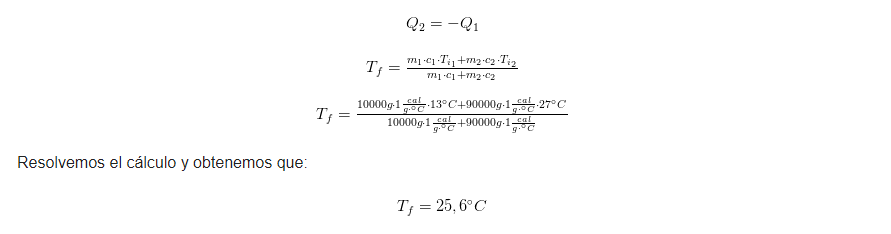Ahora nos enfocaremos en aprender que es la calorimetria en física, prácticamente desarrollaremos los conceptos de calorimetría, calor, equilibrio térmico y transferencia de calor.
Que es la calorimetria
Calor
El calor es una manera de energía que tienen los cuerpos, se plantea por medio de un crecimiento de temperatura y se transfiere de cuerpos con más temperatura hacia cuerpos con menor temperatura, procurando de conseguir la estabilidad térmico.
Equilibrio térmico
Se estima como equilibrio térmico al estado en que 2 o más cuerpos en contacto alcanzan una misma temperatura, de tal forma que el calor queda homogéneamente distribuido, hasta que no haya transferencia de calor entre ellas, esa temperatura se sabe como temperatura de equilibrio.
Imagina lo que pasa una vez que mezclas agua caliente con agua gélida en un recipiente de paredes adiabáticas, puesto que por supuesto al mezclar del todo el resultado va a ser agua tibia.
Ello ocurre pues el agua caliente transfiere calor al agua gélida hasta llegar al equilibrio térmico.
Se plantea que un sistema es adiabático una vez que es térmicamente aislante, en nuestro ejemplo comentamos un que no deja salir ni entrar calor.
Que es la Calorimetria en fisica: Transferencia de calor
Al preguntarnos que es la calorimetria, podemos decir que es la transferencia de calor; es decir el proceso por el que un cuerpo transfiere calor a otro, como ya comentamos, el calor se transfiere de los cuerpos calientes hacia los fríos. Este proceso puede pasar de numerosas posibilidades.
O sea el calor se puede transferir por: conducción, convección y radiación; ahora observaremos en qué radica todas estas maneras. Sin embargo previamente respondamos una pregunta curiosa.
Analicemos que es la calorimetria ¿El frio entra o sale?
Esta es la célebre pregunta que se plantean una vez que se estudia calorimetría o termodinámica; es bastante curioso ya que toda la vida has escuchado de padre, madre u otras personas, de que el frio entra, que cierres la puerta o las ventanas pues el frio entra, de dicha forma asumimos que el frio entra, y ya te habrás dado cuenta que está mal.
Puesto que conforme con la teoría que desarrollamos hasta ahora, es el calor el que se transfiere, no el frio.
Entonces ¿Qué pasa, el frio sale o entra? Puesto que ni una de ambas, ni sale, ni entra, lo cual realmente pasa, es que el calor sale, el calor se transfiere de cuerpos calientes a fríos y no a la inversa.
Lo cual pasa una vez que abres la puerta o la ventana en etapa de frio, es que el calor se sale para conseguir la estabilidad térmico con el exterior, de tal forma que la temperatura reduce, dando una falsa sensación de que el frio entra.
Bien ahora ya sabes, si un día cierras la ventana para evadir el frio, lo cual está procurando de hacer es que el calor de tu habitación o sitio se mantenga. Comentado esto, ahora pasemos a la descripción de las maneras de transferencia de calor.
Que es la Calorimetria física: Conducción térmica
Ver Ejercicios de calorimetria
Un claro ejemplo de este proceso se puede mirar una vez que se calienta el extremo de una varilla metálica de forma directa en el fuego, acorde pasa la era, se nota que el otro extremo además aumenta su temperatura, esto ya que el calor es conducido por medio del metal, debido a su conductividad térmica.
Tenemos la posibilidad de mencionar que la conducción térmica pasa por contacto directo, en el cual solo hay trueque de calor, sin embargo no existe trueque de masa.
Convección
Un claro ejemplo de transferencia de calor por convección es una vez que prende una vela, claramente el calor se crea por la combustión de la vela, notarás que el aire a su alrededor comienza a calentarse, el aire caliente comienza a subir puesto que su densidad es menor que la del aire frio, tal el calor se transfiere por medio del flujo de aire.
Radiación
El calor además se transmite por medio de la radiación, en esta situación el calor se transfiere por medio de ondas electromagnéticas. Un caso claro sobre esta clase de transferencia de calor, es la radiación que emite el sol a la tierra.
Unidades de calor
La unidad de medida del calor es el Joule (J), puesto que se trata de una manera de energía. Bien, sin embargo en la práctica se frecuenta utilizar como unidad la caloría (cal) y todavía más su múltiplo, la kilocaloría (kcal).
Para objetivos prácticos, se puede transformar calorías a Joule y a la inversa, sencillamente empleamos su equivalente: 1 caloría= 4,186Joule
Calor específico
El calor específico es una intensidad que tienen todos los materiales, o sea cada sustancia poseen un calor especifico, que sugiere la proporción de calor que debería triunfar o perder una unidad de masa para que su temperatura cambie en una unidad.
Que es la Calorimetria: Capacidad calorífica
Esta intensidad no es propia de los materiales, puesto que es dependiente de la proporción de material, o sea de su masa total; la capacidad calorífica nos sugiere la proporción de calor que la masa total debería ganar o perder para que su temperatura total incremente o reduzca en una unidad respectivamente.
Conservación de la energía
La ley de conservación de la energía, instituye que la energía total en un sistema físico cerrado se conserva constante en el tiempo, o sea la energía en un sistema aislado, no se se incrementa ni reduce.
En calorimetría, esto quiere decir que, una vez que 2 o más cuerpos que se hallan a diferentes temperaturas y permanecen aislados en un sistema cerrado, dichos cambian calor hasta lograr la estabilidad térmica, en este proceso, los cuerpos con menor temperatura ganan calor y los de más grande temperatura ceden calor.
El calor total ganado por los cuerpos fríos debería ser igual al calor total perdido por los cuerpos calientes. Puesto que la energía total del sistema cerrado se conserva constante.
Calorímetro de mezclas
El calorímetro de mezclas es un recipiente térmicamente aislado, o sea, no deja entrar ni salir calor, en ella el calor se conserva o por lo menos minimiza el trueque de calor con su exterior.
Equivalente en agua de un calorímetro
Como su nombre sugiere, el equivalente en agua de un calorímetro es la proporción de agua que tiene la función de triunfar o perder igual proporción de calor que un calorímetro, al hacer variar su temperatura en la misma medida.
El equivalente en agua se puede calcular multiplicando la masa del calorímetro por su calor específico y dividiendo comentado resultado entre el calor especifico del agua.
Cambio de etapa
Un cambio de etapa es un proceso causado por un cambio en el ordenamiento molecular de un material en su interior, y se expone una vez que hablado material cambia su estado de solido a líquido, de líquido a vapor y al revés.
Una ejemplo típico de este fenómeno se muestra en el agua, según la temperatura a la que se somete, este puede estar en estado líquido, sólido o vapor.
La temperatura fundamental para crear un cambio de etapa sobre un material, es dependiente de la presión. Ejemplificando, a menor presión el agua hierve a menor temperatura y a más grande presión, hierve a más grande temperatura.
- Primero: Fusión.- solido a líquido.
- Segundo: Solidificación.- de estado líquido a sólido.
- Tercero: Vaporización.- de líquido a vapor.
- Cuarto: Condensación.- una vez que el vapor se transforma en líquido.
- Quinto: Sublimación directa es el cambio de solido a vapor y la sublimación inversa es el cambio de vapor a estado sólido.
Que es la Calorimetria: Calor latente
El calor latente es una intensidad que tiene cada material, sugiere la proporción de calor que se debería ceder o restar a una unidad de masa de un material definido, para que se logre crear un cambio de etapa, bajo condiciones idóneas de presión y temperatura. Esto quiere decir existente un calor latente de: fusión, solidificación, vaporización y condensación.
Ejemplificando, el calor latente para cambios de etapa del agua a cierta presión y temperatura son los próximos valores.
Diagrama de etapas
Es una representación gráfica de la presión vs temperatura a la cual está un material, en ella tenemos la posibilidad de representar y mirar la conducta de un material una vez que se somete a cierta temperatura y presión, notaremos cómo el material cambia de etapa una vez que estos límites cambian.
Ahora describiremos los puntos de vista y curvas más relevantes del diagrama de etapas que acabamos de conocer.
Punto triple
El punto triple (A) de un material es ese en el que tienen la posibilidad de coexistir las 3 etapas del material a la misma temperatura y presión, o sea, es viable que un material esté en su estado líquido, sólido y vapor a la vez, a una temperatura y presión definida.
Curva de sublimación
Esta curva está formada por todos los puntos de vista en los cuales una sustancia coexiste en su estado sólido y vapor, esto ocurre a una temperatura y presión definida y observable en la curva.
Curva de vaporización
La curva de vaporización está formada por los aspectos en los que tienen la posibilidad de coexistir los estados líquido y vapor de una sustancia o material. Esto quiere decir que a esa temperatura y presión, el material está en estado líquido y además gaseoso, lo cual puede estar ocurriendo es que el material se se encuentre vaporizando, o en caso opuesto se se encuentre condensando.
Curva de fusión
La curva de fusión está conformada por el grupo de puntos de vista en los que el material puede coexistir en su estado sólido y líquido, o sea a una presión y temperatura definida, el material puede hallarse en estado líquido y solido a la vez.
Esto puede pasar una vez que el material está pasando de líquido a solido en un proceso de solidificación o a la inversa, una vez que pasa un fusión.
Comportamiento anómalo del agua
Estudiando que es la calorimetria, estamos con un fenómeno que llama bastante la atención y es la conducta anómalo del agua, una vez que el agua es sometida a una alteración de temperatura, pasa algo curioso:
- Una vez que se eleva la temperatura del agua de 0°C hasta los 4°C, el agua en sitio de dilatarse, se contrae.
- Sin embargo, una vez que la temperatura del agua se disminuye de 4°C hasta 0°C, esta se dilata en vez de contraerse.
Los 4°C que comentamos, en verdad son 3,98°C, puesto que a esa temperatura el agua alcanza su máxima densidad.
Ejercicios de calorimetría
Si agregamos 10 litros de agua a 13°C en un acuario de 90 litros de agua con temperatura de 27°C. ¿Qué temperatura queda en el acuario luego de agregar el agua?
Sabemos que los cálculos nos guiarán hacia la respuesta.
En primer lugar, escribamos los datos:
m1=10 000g
c1= 1 cal/g°C
Ti1= 13°C
m2=90 000g
c2= 1 cal/g°C
Ti2= 27°C
En segundo lugar, aplicamos la ecuación 3, que deriva en la ecuación 4 para hallar la temperatura final de equilibrio térmico entre las dos masas de agua: