La termodinamica es el fragmento de la física que se ocupa de la interacción entre el calor y el trabajo.
Relación entre trabajo y calor
Tanto el calor como el trabajo son métodos en que los cuerpos y los sistemas convierten su energía. Esto posibilita implantar un equivalente mecánico del calor. Observa los próximos ejemplos:
- De trabajo mecánico a calor: Frota 2 bloques de hielo, y comprobarás que se derriten, todavía una vez que estés en una camara frigorífica a una temperatura menor de 0 ºC
- De calor a trabajo mecánico: En una máquina de vapor,la extensión del vapor de agua que se calienta crea el movimiento del pistón
Trabajo y calor son procedimientos de transferencia de energía. Usan la misma unidad de medida en el Sistema Universal, el julio (J). Además, es usual usar la caloría (cal) para medir el calor. La conversión entre calorías y julios viene dada por:
1 cal=4.184 J⇔1J=0.24 cal
Esta interacción entre trabajo y calor, que hoy vemos de forma clara, no lo ha sido hasta el S. XIX. El análisis del trabajo y del calor eran disciplinas separadas: la mecánica y la termología respectivamente. De esta forma además las unidades en que se medían cada uno, julio y caloría. Alrededor del S. 18 el científico inglés James Prescott Joule creó un dispositivo capaz de medir el equivalente mecánico del calor, estableciendo, de esta forma, la equivalencia señalada.
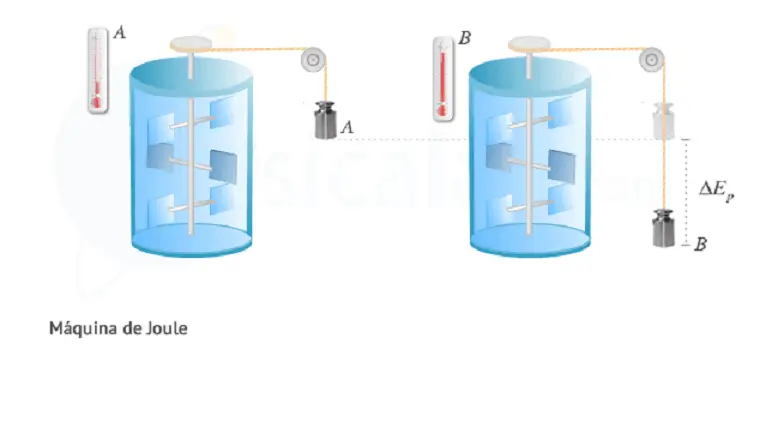
Experimento de Joule
Joule ideó una máquina constituida por una pesa unida a unas aspas mediante un sistema de poleas, que se hallan sumergidas en un recipiente de vidrio lleno de agua. Una vez que se deja caer la pesa a partir de la postura A hasta B, tal y como se muestra en la figura, esta pierde su energía potencial invirtiéndose en girar las aspas dentro del líquido. La fricción de las aspas con el agua produce un crecimiento de la temperatura del mismo. Desde los resultados logrados con esta máquina se obtuvo la equivalencia fundada antes:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal
¿Qué estudia la termodinámica?
La termodinámica procede de 2 disciplinas separadas hasta el S.XIX, la termología y la mecánica. La primera se delegaba de los fenómenos exclusivamente térmicos y la segunda trataba el desplazamiento, la fuerza y el trabajo.
La termodinámica es la porción de la física que estudia las transferencias de calor, la conversión de la energía y la funcionalidad de los sistemas para crear trabajo. Las leyes de la termodinámica argumentan los comportamientos globales de los sistemas macroscópicos en situaciones de equilibrio.
Tiene estas propiedades:
- Se aplica al análisis de sistemas que tienen dentro muchas partículas y no al análisis de moléculas, átomos o partículas subatómicas
- Estudia el sistema en situaciones de equilibrio, que son esas a las que sistema tiende a avanzar y caracterizadas pues en ellas cada una de las características del sistema quedan determinadas por componentes intrínsecos y no por influencias externas anteriormente aplicadas.
- Sus postulados son indemostrables, permanecen basados en las vivencias y no en razonamientos teóricos.
Es fundamental que te familiarices con los conceptos que iremos a meter en seguida, puesto que, aun cuando en una primera aproximación tienen la posibilidad de parecer algo abstractos, te permitirían aprender la conducta de sistemas concretos ( un motor, un inflador de aire, etcétera ) con bastante exactitud.
Componentes de un sistema termodinámico
Sistema
El sistema es el fragmento del cosmos que iremos a aprender. Ejemplificando, un gas, nuestro cuerpo humano o la atmósfera son ejemplos de sistemas que tenemos la posibilidad de aprender a partir de la perspectiva termodinámica.
Entorno o ambiente
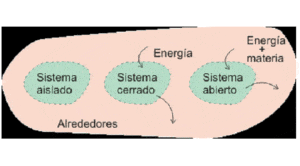
Todo eso que no es sistema y que se ubica cerca de él, se llama ambiente o ámbito. Los sistemas interaccionan con el ámbito transfiriendo masa, energía o ambas cosas. En función de eso los sistemas se ordenan en:
El tipo Abierto intercambia la Masa y energía (trabajo o calor). Ejemplificando: Reacción química en tubo de ensayo abierto.
El tipo Cerrado intercambia únicamente energía. Ejemplificando: Radiador de calefacción.
El tipo Aislado intercambia Ni materia ni energía. Ejemplificando: Termo para conservar bebidas a temperatura constante.
El tipo Adiabático intercambia Ni materia ni calor, empero si energía a modo de trabajo. Ejemplificando: Termo con tapa que posibilite variar volumen
Frontera o paredes del sistema
Por medio de ellas se comunica el sistema con el ámbito. Hay los próximos tipos:
- Estáticas: Mantienen el volumen constante
- Móviles: El volumen es variable y es dependiente de la presión en el lado del sistema y de la del ámbito
- Conductoras o diatérmanas: Al conducir calor permiten que la temperatura a los dos lados de la misma sea igual
- Adiabáticas: No conducen calor. Son los aislantes térmicos
Variables y ecuación de estado
Las cambiantes de estado son el grupo de valores que adoptan ciertas cambiantes físicas y químicas y que nos permiten caracterizar el sistema. A las cambiantes de estado además se las llama funcionalidades de estado. No todos los sistemas termodinámicos poseen el mismo grupo de cambiantes de estado. En la situación de los gases son:
- presión
- volumen
- masa
- temperatura
Las cambiantes de estado de una sustancia se relacionan por medio de una ecuación de estado propia de la sustancia de forma que, estableciendo un costo a muchas de ellas, quedan determinadas lo demás. Ejemplificando, se comprueba experimentalmente que si establecemos el volumen y la temperatura de una cierta proporción de un gas, su presión no se puede cambiar. En este asunto nos centraremos constantemente en el análisis de los gases, además de por su relativa simplicidad, por ser de gran interés para el análisis de sistemas termodinámicos tales como el motor de la máquina de vapor, precursor de los recientes motores.
La ecuación de estado de los gases ideales
La ecuación de estado de los gases ideales sigue la expresión:
p⋅V=n⋅R⋅T
Donde:
- p: Presión. Su unidad de medida en el Sistema Mundial es el pascal ( Pa ) aun cuando además se frecuenta utilizar la atmósfera ( atm ). 1 atm = 101325 Pa
- V: Volumen. Su unidad de medida en el Sistema Universal es metro cúbico ( m3 ) aun cuando además se frecuenta utilizar el litro ( l o L ). 1 L = 1 dm3 = 10-3m3
- n: Número de moles. Hablamos de una unidad de masa. Un mol de una sustancia está formado del número de Avogadro, NA = 6.023•1023 de moléculas de dicha sustancia, y su peso coincide con la masa molecular de la sustancia expresada en gramos. La unidad de medida en el Sistema Mundial para el número de moles es el mol ( mol )
- R: Constante mundial de los gases. Su costo en unidades del Sistema Universal es R = 8.31 J / mol•K, aun cuando además se utiliza R = 0.083 atm•l / mol•K
- T: Temperatura. Su unidad de medida en el Sistema Universal es el kelvin ( K ) aun cuando además se frecuenta utilizar el nivel centígrado o celsius ( ºC ). T = tC + 273.15
Rememora que un gas ideal no es más que un gas teórico en el cual sus partículas, con movimiento aleatorio, no interactúan entre sí. La mayor parte de los gases reales, a temperaturas subjetivamente altas y presiones pequeñas tienen la posibilidad de considerarse gases ideales y por consiguiente tenemos la posibilidad de utilizar esta expresión como su ecuación de estado en los ejercicios de este asunto.
Al final, mencionamos que un sistema alcanzó el estado de equilibrio una vez que sus cambiantes de estado están constantes. Cada una de las características del sistema en equilibrio quedan determinadas por componentes intrínsecos y no por influencias externas anteriormente aplicadas. La termodinámica únicamente se delega de sistemas en estado de equilibrio.
Variables intensivas y extensivas
- Intensivas: Son esas que no dependen del tamaño del sistema. ejemplificando la presión, la temperatura, la concentración o la densidad
- Extensivas: Son esas que dependen del tamaño del sistema. Ejemplificando el volumen, la masa o la energía
Las leyes de la termodinamica
Las leyes de la termodinámica son principios empíricos que no se pueden enseñar por estar basados en la vivencia y no en razonamientos teóricos. Permanecen referidos a sistemas en estado de equilibrio. Son 4, aun cuando los más relevantes son el primero y el segundo:
- Principio cero de la termodinámica
- Primer Principio de la termodinámica
- Segundo Principio de la termodinámica
- Tercer Principio de la termodinámica
Criterio de signos en termodinámica
Hay 2 criterios de signos extensamente extendidos en termodinámica para relacionar el trabajo y el calor que intercambia un sistema con el ámbito:
- Criterio de la IUPAC: Se estima positivo todo lo cual se incrementa la energía del sistema, o sea, calor recibido y trabajo recibido
- Criterio Clásico: Se estima positivo el calor recibido por el sistema y el trabajo que ejecuta el sistema sobre el ámbito. Este criterio es util en el análisis de aparatos térmicas en el cual atrae que el trabajo llevado a cabo por las máquinas (el sistema) sea positivo.